Wraz ze starzeniem się społeczeństwa ZWIĘKSZA SIĘ ILOŚĆ przyjmowanych leków. w przyszłości MOŻE TO powodować wzrost zagrożeń związanych z interakcjami lekowymi i POŁĄCZONYMI z nimi działaniami niepożądanymi. Dobra znajomość mechanizmu interakcji lekowych pozwala jednak na uniknięcie zmian w farmakokinetyce leków.
Farmakoterapia we współczesnej medycynie to powszechna forma leczenia większości chorób. Postępy farmakoterapii i rozwój wiedzy społeczeństwa o sprawach zdrowia niestety nie przekładają się na jej zadowalający efekt. Niepowodzenie farmaceutyczne związane jest przede wszystkim z tym, że ludzie nie dostosowują się do prawidłowej farmakoterapii. Brak zdyscyplinowania pacjentów w przestrzeganiu zalecanego sposobu leczenia oraz błędy w stosowaniu leków sprzyjają niepowodzeniu terapeutycznemu.
Za główne przyczyny wystąpienia działań niepożądanych uważa się brak pełnej informacji o sposobie dawkowania leku oraz nieumiejętność pacjenta w skoordynowaniu leczenia zalecanego przez różnych lekarzy. Zwłaszcza ludzie starsi, mający trudność z zapamiętywaniem kolejności przyjmowanych leków, przyjmują wszystkie preparaty razem, co może prowadzić do interakcji lekowych[1,2,3,4].
Interakcje pomiędzy jednocześnie stosowanymi lekami należą do najczęściej występujących problemów lekowych. Powszechność problemu interakcji lekowych w Polsce nie została dokładnie potwierdzona na podstawie danych z kontrolowanych badań epidemiologicznych, co wynika z niedostatecznej ilości zgłoszeń tego typu zdarzeń do ośrodków zajmujących się ich monitorowaniem. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych w Polsce szacuje, że od 3 do 5 proc. przyjęć do szpitala jest wynikiem poważnych interakcji lekowych[4,5].
Interakcje leków ze względu na znaczenie kliniczne można podzielić na groźne (zagrażające życiu pacjenta), istotne (wymagające dodatkowego leczenia) oraz klinicznie nieistotne (niepowodujące skutków klinicznych). Znajomość interakcji w medycynie klinicznej jest ważna, ponieważ pozwala przewidzieć niebezpieczeństwo z nimi związane[6].
Działanie i stopień mocy interakcji lekowej może różnić się znacząco u każdego pacjenta. W grupie zwiększonego ryzyka znajdują się przede wszystkim starsi pacjenci, u których występują schorzenia współistniejące. Szacuje się, że pacjenci po 65. roku życia przyjmują 6‑7 leków na receptę oraz 2 leki, które można zakupić bez recepty lekarskiej. Ponadto wraz z wiekiem zachodzą istotne zmiany w organizmie człowieka, co ma wpływ na farmakokinetykę leku i może powodować zagrożenie wystąpieniem interakcji lekowych. Osoby starsze z upośledzoną czynnością wątroby oraz nerek są bardziej narażone na interakcje lekowe[7,8,9,10].
Definicja
Interakcja lek – lek definiowana jest jako wpływ jednego leku na działanie farmakologiczne drugiego, równocześnie podanego leku. Zależy bezpośrednio od liczby przyjmowanych jednocześnie leków oraz czynników indywidualnych takich jak: wiek, rasa, płeć lub stosowane używki[11,12].
Leki mogą wpływać na swoje działanie w różny sposób, co może skutkować nasileniem lub osłabieniem ich działania. Interakcje mogą być szkodliwe dla ustroju człowieka ze względu na zwiększenie toksyczności leku[5,11,12]. Interakcje w organizmie mogą wystąpić w fazie farmakodynamicznej i farmakokinetycznej[5,11,12].
Interakcje farmakodynamiczne
Interakcja farmakodynamiczna polega na wzajemnym modyfikowaniu siły i czasu działania jednego leku pod wpływem efektu farmakologicznego drugiego równocześnie stosowanego leku.
Interakcje farmakodynamiczne w przeciwieństwie do interakcji farmakokinetycznych nie wpływają na stężenie leku w osoczu oraz na miejsce jego działania[5,13,14].
Interakcji farmakodynamicznych można spodziewać się, kiedy substancje farmakologicznie czynne działają antagonistycznie lub synergistycznie na ten sam receptor, efektor lub procesy sprzężenia zwrotnego. W wyniku powyższego można dokonać podziału interakcji farmakodynamicznych ze względu na mechanizmy działania na receptorowe, enzymatyczne i fizjologiczne (czynnościowe)[5,13,14].
Interakcje receptorowe i enzymatyczne występują w przypadku zastosowania leków działających na ten sam receptor lub enzym, a fizjologiczne, gdy leki działające na różne receptory lub enzymy przez różne mechanizmy działania, powodują takie same lub przeciwne skutki fizjologiczne[14,15,16].
Interakcje synergistyczne
Synergizm to zgodne, jednokierunkowe działanie leków prowadzące do wzmożonego efektu ich działania. Wyróżniamy synergizm addycyjny i hiperaddycyjny[5,14,15,16].
Synergizm addycyjny definiowany jest jako forma interakcji, w której działanie leków podanych razem jest równe sumie działania poszczególnych składników. Występuje wówczas, gdy leki mają taki sam punkt uchwytu i mechanizm działania[5,14,15,16].
Synergizm hiperaddycyjny (potencjalizacja) zachodzi, gdy dwa leki podane razem wywierają efekt farmakologiczny znacznie większy niż suma działania poszczególnych składników. Występuje wtedy, gdy leki mają różne punkty uchwytu lub inne mechanizmy działania[5,14,15,16].
Interakcje antagonistyczne
Antagonizm jest to przeciwne, różnokierunkowe działanie leków, które mogą znosić lub hamować wzajemnie swoje oddziaływanie. Wyróżniamy 4 rodzaje antagonizmu: kompetycyjny, niekompetycyjny, czynnościowy i chemiczny[5,14,15,16].
Antagonizm kompetycyjny występuje wówczas, gdy leki mają ten sam punkt uchwytu, natomiast antagonizm niekompetycyjny, gdy punkty uchwytu działania agonisty i antagonisty są różne[5,14,15,16].
Antagonizm czynnościowy występuje wówczas, gdy dwa leki mają przeciwne działanie na dwa różne receptory tego samego narządu, a antagonizm chemiczny polega na wzajemnym neutralizowaniu się leków[5,14,15,16].
Interakcje farmakokinetyczne
Interakcje leków mogą zachodzić na różnych etapach losu leku w organizmie, wpływając przede wszystkim na jego stężenie w ustroju. Interakcje w fazie farmakokinetycznej zachodzą w układzie LADME (akronim odzwierciedlający los leku w ustroju, rycina)[17,18,19,20]: uwalnianie (liberation), wchłanianie (absorption), dystrybucja (distribution), metabolizm (metabolism) i wydalanie (excretion).
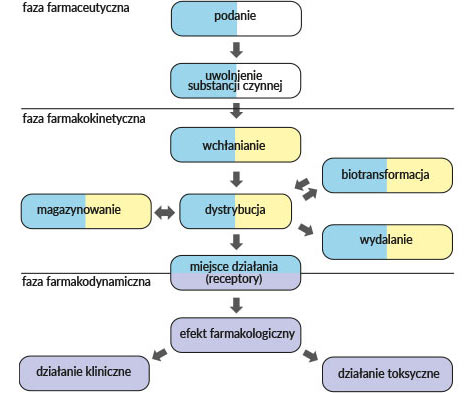
Interakcje na etapie wchłaniania
Większość leków przyjmowanych doustnie wchłania się przez błony śluzowe przewodu pokarmowego. Przejście leków przez błony śluzowe następuje na zasadzie dyfuzji biernej i zależy od stopnia, w jakim występują leki w postaci rozpuszczalnej w tłuszczach i niezjonizowanej. Wchłanianie jest regulowane przez rozpuszczalność leku w tłuszczach, pH treści jelit i parametry związane z farmaceutyczną postacią leku.
Istnieje kilka mechanizmów powodujących interakcje na etapie wchłaniania leków z przewodu pokarmowego[5,17,18,19,20]:
- zmiana pH treści żołądkowo-jelitowej,
- adsorpcja,
- chelatowanie,
- zmiana motoryki przewodu pokarmowego,
- zmniejszenie przepływu krwi przez jelita,
- indukcja lub inhibicja białek transportujących leki,
- zespół złego wchłaniania wywołany przez stosowane leki.
Interakcje na etapie dystrybucji
Większość leków po przejściu przez barierę jelito – krew wiąże się z białkami osocza. Cząsteczki leków związane z białkami są farmakologicznie nieczynne, natomiast cząsteczki wolne są odpowiedzialne za działanie farmakologiczne.
Leki mogą współzawodniczyć o miejsce wiązania z białkami osocza. Prowadzi to do uwolnienia większej frakcji wolnego leku i nasilenia działania farmakologicznego. Wyparcie leku z wiązań z białkami powoduje również jego szybszą eliminację z krwiobiegu. Wypieranie leków z połączeń z białkami dotyczy leków: silnie wiążących się z białkami, o małej objętości dystrybucji, o wąskim indeksie terapeutycznym[5,17,18,19,20].
Wiązanie określonego leku z albuminami osocza zależy od pH środowiska. Zakwaszenie krwi może zwiększyć stopień wiązania leków o charakterze słabych kwasów, natomiast alkalizacja zwiększa wiązanie leków zasadowych.
Interakcje na etapie biotransformacji
Metabolizm leków można podzielić na dwie fazy. Faza pierwsza obejmuje procesy utleniania, redukcji i hydrolizy, w wyniku której leki ulegają przekształceniu w związki o zwiększonej polarności. Faza druga polega na łączeniu leków ze związkami endogennymi i prowadzi do powstania zazwyczaj związków nieaktywnych, przygotowanych do wydalenia z organizmu z moczem lub żółcią. Głównym celem obu faz jest zwiększenie rozpuszczalności leków w wodzie, by ułatwić ich wydalanie[21,22,23,24].
Większość leków metabolizowana jest w wątrobie przy udziale mikrosomalnego układu izoenzymów cytochromu P-450 (CYP450). Dotychczas wykryto kilkanaście izoenzymów CYP450 istotnych w procesie biotransformacji leku (CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4/A5)[21,22,23,24].
W związku z występowaniem polimorfizmu genetycznego enzymów, biorących udział w biotransformacji leków w organizmie, w danej populacji można wyróżnić fenotypowo odmienne grupy: osoby z fenotypem szybkiego metabolizowania leku lub defektem genetycznym, które źle metabolizują leki. Różne leki wykazują indukujący lub hamujący wpływ na aktywność izoenzymów. Indukcja enzymów powoduje zwiększenie stężenia i skrócenie czasu półtrwania leku, a hamowanie aktywności enzymu proces odwrotny[21,22,23,24].
Interakcje na etapie wydalania
Wydalanie leku lub jego metabolitów prowadzi do zmniejszenia stężenia substancji czynnej w organizmie. Wydalanie może odbywać się: drogą nerkową (z moczem), z żółcią lub drogą jelitową (z kałem), drogą oddechową (razem z wydalanym powietrzem) oraz przez skórę i jej przydatki.
Interakcje na etapie wydalania leków mogą zachodzić w wyniku zmiany w wydalaniu leków przez nerki (zmiany pH moczu, zmiany aktywnego transportu przez kanaliki nerkowe, zmian w przepływie krwi przez nerkę); interakcji związanych z białkami transportującymi leki (P-glikoproteiny, OATs – Organic anion transporters, OCTs – Organic cation transporters) oraz zmian w wydalaniu leków z żółcią i poprzez krążenie wątrobowo-jelitowe.
Główną drogą wydalania leków są nerki. Zmiany pH moczu przez wpływ na jonizację leków o charakterze słabych kwasów i słabych zasad mogą modyfikować ich eliminację. Leki zakwaszające mocz zmniejszają jonizację leków kwaśnych i wzmagają ich resorpcję, zatem hamują ich wydalanie, a tym samym wzmagają i przedłużają ich działanie. Alkalizacja moczu prowadzi do zahamowania wydalania leków zasadowych wskutek zmniejszenia ich jonizacji, a zakwaszenie do zwiększonego ich wydalania z powodu zwiększenia ich jonizacji[25,26,27,28].
Interakcje na etapie zmian aktywnego transportu przez kanaliki nerkowe mogą zachodzić poprzez współzawodnictwo leków o ten sam system transportu aktywnego w kanalikach nerkowych. Leki, które hamują lub konkurują o ten sam system transportu aktywnego w kanalikach nerkowych, mogą zmniejszać wydalanie leku, a tym samym zwiększać jego ilość w organizmie [25,26,27,28].
Przepływ krwi przez nerki jest częściowo kontrolowany przez produkcję nerkowych prostaglandyn rozszerzających naczynia nerkowe. Jeśli synteza tych prostaglandyn zostanie zahamowana, wydalanie nerkowe niektórych leków może zostać zmniejszone. Na wydalenie leków mogą mieć również wpływ choroby nerek (na przykład przewlekłe zapalenie nerek)[25,26,27,28].
Podsumowanie
Wraz ze starzeniem się społeczeństwa oraz zwiększoną ilością przyjmowanych leków w przyszłości nastąpi wzrost zagrożeń związanych z interakcjami lekowymi i połączonymi z nimi działaniami niepożądanymi. Narastający problem polipragmazji i interakcji lekowych dotyczy szczególnie pacjentów w wieku podeszłym. Chociaż trudno jest pozyskać kompletne, ogólnoeuropejskie dane, wyniki badań epidemiologicznych, przeprowadzonych na poziomie poszczególnych krajów sugerują, że częstotliwość występowania interakcji lekowych wzrasta i może być groźna dla zdrowia pacjentów. Dobra znajomość mechanizmu interakcji lekowych pozwala jednak na uniknięcie zmian w farmakokinetyce leków.
Piśmiennictwo
1. Orzechowska-Juzwenko K. Farmakologia kliniczna, Znaczenie w praktyce medycznej. Górnicki Wydawnictwo Medyczne, Wrocław 2006.
2. Kostowski W., Herman Z. Farmakologia – podstawy farmakoterapii tom 1-2. PZWL, Warszawa 2004.
3. Korzeniowska K., Balcer N., Jabłecka A. Monitorowanie działań niepożądanych leków metodą redukcji zagrożeń zdrowotnych. Prob. Hig. Epidemiol. 2009, 90: 222–225.
4. Hall J. Kryteria oceny pojedynczego zgłoszenia niepożądanego działania produktu leczniczego. Lek w Polsce, 2009, 19: 73-79.
5. Kostka-Trąbka E., Woroń J. Interakcje leków w praktyce klinicznej. PZWL, Warszawa 2006.
6. Malone DC, Abarca J, Hansten PD, Grizzle AJ, Armstrong EP, Van Bergen RC, Duncan-Edgar BS, Solomon SL, Lipton RB. Identification of serious drug-drug interactions: results of the partnership to prevent drug-drug interactions. J Am Pharm Assoc. 2003, 44(2): 142-51.
7. Wieczorkowska-Tobiś K, Grześkowiak E, Jóźwiak A. Farmakoterapia geriatryczna. Akademia Medycyny, Warszawa, 2008.
8. Marcum ZA, Driessen J, Thorpe CT, Gellad WF, Donohue JM. Effect of multiple pharmacy use on medication adherence and drug-drug interactions in older adults with Medicare Part D. J Am Geriatr Soc. 2014, 62(2): 244-52.
9. Turnheim K. Drug therapy in the elderly. Exp Gerontol. 2004, 39(11-12):1731-8.
10. Johnell K, Klarin I. The relationship between number of drugs and potential drug-drug interactions in the elderly: a study of over 600,000 elderly patients from the Swedish Prescribed Drug Register. Drug Saf. 2007, 30(10):911-8.
11. Dumbreck S, Flynn A, Nairn M, Wilson M, Treweek S, Mercer SW, Alderson P, Thompson A, Payne K, Guthrie B. Drug-disease and drug-drug interactions: systematic examination of recommendations in 12 UK national clinical guidelines. BMJ. 2015, 350:h949.
12. Guthrie B, Makubate B, Hernandez-Santiago V, Dreischulte T. The rising tide of polypharmacy and drug-drug interactions: population database analysis 1995-2010. BMC Med. 2015, 13:74.
13. Strandell J, Wahlin S. Pharmacodynamic and pharmacokinetic drug interactions reported to VigiBase, the WHO global individual case safety report database. Eur J Clin Pharmacol. 2011, 67(6):633-41.
14. Jachowicz R. Farmacja praktyczna. Wydawnictwo Lekarskie PZWL, Warszawa 2008.
15. Janiec W, Krupińska J. Farmakodynamika. Wydawnictwo Lekarskie PZWL, Warszawa 1999.
16. Zejc A, Gorczyca M. Chemia leków. Wydawnictwo Lekarskie PZWL, Warszawa 2002.
17. Benedetti MS, Whomsley R, Poggesi I, Cawello W, Mathy FX, Delporte ML, Papeleu P, Watelet JB. Drug metabolism and pharmacokinetics. Drug Metab Rev. 2009, 41(3): 344-90.
18. Church MK, Gillard M, Sargentini-Maier ML, Poggesi I, Campbell A, Benedetti MS. From pharmacokinetics to therapeutics. Drug Metab Rev. 2009, 41(3):455-74.
19. Hermann TW. Farmakokinetyka : teoria i praktyka. Wydawnictwo Lekarskie PZWL, Warszawa 2002.
20. Grabowski T. Farmakokinetyka i Biofarmacja. Warszawa 2000-2008.
21. Durnas C, Loi CM, Cusack BJ. Hepatic drug metabolism and aging. Clin Pharmacokinet. 1990, 19(5):359-89.
22. Miksys S, Tyndale RF. Cytochrome P450-mediated drug metabolism in the brain. J Psychiatry Neurosci. 2013, 38(3):152-63.
23. Zanger M, Schwab M. Cytochrome P450 enzymes in drug metabolism: Regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacology & Therapeutics. 2013, Volume 138, Issue 1: 103–141.
24. Danielson PB. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. Curr Drug Metab. 2002, 3(6):561-97.
25. Dresser MJ, Leabman MK, Giacomini KM. Transporters involved in the elimination of drugs in the kidney: organic anion transporters and organic cation transporters. J Pharm Sci. 2001, 90(4):397-421.
26. Lee W, Kim RB. Transporters and renal drug elimination. Annu Rev Pharmacol Toxicol. 2004, 44:137-66.
27. El-Sheikh AA, Masereeuw R, Russel FG. Mechanisms of renal anionic drug transport. Eur J Pharmacol. 2008, 13;585(2-3):245-55.
28. Inui KI, Masuda S, Saito H. Cellular and molecular aspects of drug transport in the kidney. Kidney Int. 2000, 58(3):944-58.






