We współczesnej farmakoterapii coraz częściej zauważalne jest pojawianie się produktów leczniczych, których substancją czynną są enancjomery stosowanych dotąd mieszanin racemicznych. U podstaw tego praktycznego oraz rynkowego podejścia jest poszukiwanie leków o efektywniejszym i bardziej optymalnym profilu terapeutycznym, A TAKŻE profilu bezpieczeństwa.
Stosowanie enancjomerów pozwala na optymalizację efektu klinicznego stosowanych dotychczas mieszanin racemicznych z jednej strony, z drugiej pozwala na zmniejszenie częstości i natężenia niepożądanych działań, które mogą towarzyszyć stosowanej farmakoterapii. Enancjomery mają zwykle odrębne właściwości pod względem farmakokinetycznym, farmakodynamicznym czy w profilu działań niepożądanych.
Chiralność i jej znaczenie w farmakoterapii
W przypadku wielu leków wzór sumaryczny niewiele mówi o budowie związku, ponieważ cząsteczki mające ten sam skład atomowy mogą różnić się sposobem i kolejnością powiązania atomów lub ich rozmieszczeniem w przestrzeni, co będzie wpływało m.in. na sposób wiązania leków z receptorami docelowymi. Jedną z przyczyn chiralności jest obecność asymetrycznego atomu w budowie cząsteczki, czyli tzw. centrum chiralności. Takim atomem asymetrycznym jest atom węgla, z którym związane są cztery różne atomy lub grupy atomów. Dla właściwego zrozumienia chiralności i jej znaczenia w farmakoterapii w aspekcie praktycznym niezbędne jest przypomnienie, że:
- stereoizomery są to związki, które mają taki sam wzór sumaryczny i identyczną konstytucję, lecz różnią się rozmieszczeniem przestrzennym atomów;
- enancjomery są to stereoizomery będące swymi lustrzanymi odbiciami. W zależności od konfiguracji atomu węgla, izomery oznacza się literami R (łac. rectus) lub S (łac. sinister). W zależności od kierunku skręcania światła spolaryzowanego dzieli się je na lewoskrętne, oznaczone symbolem (–) oraz prawoskrętne, oznaczone (+);
- stereoselektywność to z kolei preferencja jednego stereoizomeru względem drugiego w procesach fizjologicznych, a także w działaniu farmakodynamicznym licznych leków, co w sposób bezpośredni przekłada się na praktykę kliniczną.
Z kolei mieszanina racemiczna to równocząsteczkowa mieszanina postaci lewo- i prawoskrętnej, a jej działanie farmakologiczne kliniczne oraz profil bezpieczeństwa może być różny w stosunku do enancjomerów. Na rynku farmaceutycznym istnieją liczne produkty lecznicze dostępne jako enancjomery, które w większości przypadków zmieniły oblicze prowadzonej farmakoterapii co do skuteczności i bezpieczeństwa, zebrano je w tabeli 1.
| Tabela 1. Produkty lecznicze dostępne na rynku farmaceutycznym jako enancjomery | |
| ibuprofen | deksibuprofen |
| ketoprofen | deksketoprofen |
| ofloksacyna | lewofloksacyna |
| bupiwakaina | lewobupiwakaina |
| omeprazol | esomeprazol |
| lanzoprazol | dekslanzoprazol |
| cetyryzyna | lewocetyryzyna |
| citalopram | escitalopram |
Z punktu widzenia jakościowego substancja czynna mająca co najmniej jedno centrum chiralne może być produkowana jako racemat, pojedynczy enancjomer lub mieszanina enancjomerów i/lub diastereoizomerów, nierównomolowa mieszanina enancjomerów. Korzyścią wprost z zastępowania mieszanin racemicznych enancjomerami jest możliwość stosowania niższych dawek leków, co przekłada się na zmniejszenie ryzyka występowania działań niepożądanych w zakresie zależnym od zastosowanego leku. Pozwala także na zwiększenie skuteczności terapeutycznej pojedynczej dawki leku, a także uniknąć licznych niekorzystnych interakcji w politerapii. Kolejnym korzystnym efektem wynikającym z działania enancjomerów jest minimalizacja różnic międzyosobniczych dotyczących metabolizmu leków oraz zmniejszenie toksyczności spowodowanej obecnością nieaktywnych stereoizomerów. Enancjomery mają coraz większe znaczenie w farmakoterapii bólu, gdzie szczególnie z uwagi na profil działań niepożądanych NLPZ poszukujemy skutecznych i praktycznych sposobów poprawy profilu bezpieczeństwa stosowanych leków.
Deksketoprofen
Jednym z bezsprzecznych przykładów takiej właśnie korzyści wynikającej ze stosowania enancjomerów w praktyce klinicznej jest wprowadzony w 1998 roku do lecznictwa deksketoprofen. To, że dzisiaj deksketoprofen może być dostępny bez konieczności wizyty u lekarza, jest uznaniem zarówno jego skuteczności, jak i bezpieczeństwa stosowania. Trometamol deksketoprofenu należy do grupy klasycznych niesteroidowych leków przeciwzapalnych (NLPZ) o silnym działaniu przeciwbólowym, przeciwzapalnym i przeciwgorączkowym. Efekt farmakologiczny NLPZ wyraża się poprzez działanie na enzym COX. Hamowanie obwodowe tych enzymów zmniejsza syntezę prozapalnych prostaglandyn (PG) i tromboksanu, nie bez znaczenia w tym względzie jest również wpływ deksketoprofenu na modulowanie przewodzenia bodźców bólowych oraz ograniczanie hiperalgezji, co w istotny sposób zapobiega transformacji bólu ostrego w ból przewlekły. Warto przypomnieć, że deksketoprofen oprócz wpływu na zahamowanie produkcji prostaglandyn, dodatkowo hamuje czynnik transkrypcji jądrowego białka kB odpowiedzialnego za ekspresję genu cytokin, a poprzez wpływ na nadrdzeniowe szlaki cholinergiczne dodatkowo wykazuje silne działanie przeciwbólowe i powoduje wysoką skuteczność w leczeniu bólu w szczególności o podłożu zapalnym, a także gorączki.
Deksketoprofen jest prawoskrętnym, czynnym farmakologicznie izomerem powszechnie stosowanego ketoprofenu. Ponieważ ketoprofen jest racematem, a właściwości przeciwbólowe ketoprofenu są ograniczone do jego aktywnego S (+) enancjomeru, R (-) enancjomer jest terapeutycznym balastem i wywołuje wyłącznie działania niepożądane bez działania terapeutycznego. Deksketoprofen zastosowany w połowie dawki ketoprofenu wykazuje ten sam efekt przeciwbólowy, charakteryzując się szybszym początkiem działania. Dobra tolerancja 25 mg deksketoprofenu wykazuje porównywalny efekt przeciwbólowy do 50 mg ketoprofenu. Obciążenie metaboliczne pacjenta może być tym samym dwukrotnie mniejsze, a działania niepożądane mogą być zredukowane poprzez eliminację enancjomeru, jak już wspomniano, pozbawionego działania przeciwbólowego. W badaniach klinicznych wykazano optymalną skuteczność analgetyczną w zwalczaniu bólu o charakterze ostrym o natężeniu od słabego do umiarkowanego. Udowodniono skuteczność terapeutyczną w uśmierzaniu bólu po ekstrakcji zęba, bólu pooperacyjnego, rwy kulszowej, kolki nerkowej, zespołu bolesnego miesiączkowania oraz bólu kostno-mięśniowego zarówno w zaostrzeniach procesu przewlekłego, wywołanego chorobą zwyrodnieniową, jak i ostrego, pourazowego. Deksketoprofen wykazuje także znamienny i szybki efekt przeciwgorączkowy. Maksymalne stężenie osiąga po 30 minutach w przypadku podania tabletki, a w ciągu 15-20 minut po podaniu granulatu do sporządzania roztworu doustnego, podczas gdy racemat ketoprofen T max osiąga po 1 h 22 minutach. W przypadku gdy mamy do czynienia z bólem ostrym, ważny jest czas od podania leku do pojawienia się efektu przeciwbólowego. Im szybciej lek rozpoczyna działanie, tym lepiej. Warto pamiętać, że im dłuższy czas od pojawienia się efektu analgetycznego, tym większe jest ryzyko przyjęcia przez pacjenta wyższych dawek leku i związanych z tym działań niepożądanych.
Profil farmakokinetyczno-farmakodynamiczny
Deksketoprofen z uwagi na profil farmakokinetyczno-farmakodynamiczny ulega szybkiemu wchłanianiu z przewodu pokarmowego, charakteryzuje się wysoką biodostępnością po podaniu doustnym. Wiele czynników wpływa na wchłanianie leku w przewodzie pokarmowym: postać farmaceutyczna, stabilność w środowisku kwaśnym, wrażliwość na enzymy, perystaltyka jelit i obecność pokarmu w żołądku. Jednak dwa najważniejsze czynniki to rozpuszczalność w tłuszczach i rozpuszczalność w płynie. Deksketoprofen jest wysoce lipofilny. Jego sól z trometaminą dostępna w preparacie rozpuszczalnym jest bardzo dobrze rozpuszczalna w wodzie, co decyduje o drugim ważnym elemencie, jakim jest szybkie rozpuszczanie w przewodzie pokarmowym.
Deksketoprofen trometamolu rozpuszcza się w wodzie ponad 100 razy lepiej niż lek w postaci czystego kwasu, co znacząco potencjalizuje efekt działania leku oraz sprawia, że efekt ten pojawia się w krótkim czasie od podania leku. Oba te czynniki przyczyniają się więc do szybkiego i pełniejszego wchłaniania w górnej części przewodu pokarmowego, powodując mniejszą ekspozycję na lek w dalszej części jelit. Przypuszcza się, że we wchłanianiu leku, oprócz dyfuzji biernej, uczestniczą również inne mechanizmy transportu. Stężenie maksymalne (Cmax), które występuje w zależności od zastosowanej postaci leku po 15-20 minutach od podania, w postaci granulatu doustnego jest o około 30 proc. wyższe w porównaniu z innymi doustnymi postaciami. Deksketoprofen wykazuje działanie przeciwbólowe zbliżone siłą działania do metamizolu, co więcej, z metamizolem wykazuje synergizm działania terapeutycznego w aspekcie działania przeciwbólowego i przeciwgorączkowego. U pacjentów po ekstrakcjach zębów wykazano, że w czasie pierwszej godziny po podaniu, deksketoprofen wykazywał silniejszy efekt analgetyczny niż ibuprofen. W modelu bólu wywołanego ekstrakcją zęba, deksketoprofen w dawce doustnej 25 mg wykazywał silniejszy i szybszy efekt działania w porównaniu z 575 mg metamizolu lub 600 mg ibuprofenu oraz porównywalny z dwukrotnie większą dawką ketoprofenu (50 mg). Deksketoprofen po podaniu doustnym wykazuje profil kinetyczny gwarantujący szybszy początek efektu analgetycznego w porównaniu z ketoprofenem, co zawdzięcza właśnie zastosowaniu enancjomeru. Dawką rekomendowaną dla deksketoprofenu w tym wskazaniu jest 25 mg co 8 godzin. W przypadku kolki nerkowej deksketoprofen wykazuje wysoką skuteczność przeciwbólową oraz synergizm działania z metamizolem, a także z lekami z grupy spazmolityków muskulotropowych, np. drotaweryną. Jak wynika z praktyki klinicznej wynikającej z przedstawionych badań skuteczności deksketoprofenu w wybranych jednostkach klinicznych, należy podkreślić jego skuteczność analgetyczną, szybki początek efektu przeciwbólowego oraz mniejsze ryzyko występowania działań niepożądanych ze strony przewodu pokarmowego w porównaniu ze stosowaniem mieszaniny racemicznej. Należy także przypomnieć o dobrej tolerancji leku. W przypadku bólu ostrego może być podawany nawet przed posiłkiem. Charakteryzuje się niewielkim ryzykiem interakcji z innymi równocześnie stosowanymi lekami, Ważne jest także, że deksketoprofen wykazuje blisko dwukrotnie mniejsze szacowane ryzyko krwawień z górnego odcinka przewodu pokarmowego w porównaniu z ketoprofenem, naproksenem czy kwasem salicylowym, co jest istotnym argumentem do wykorzystania w praktyce (tabela 2.).
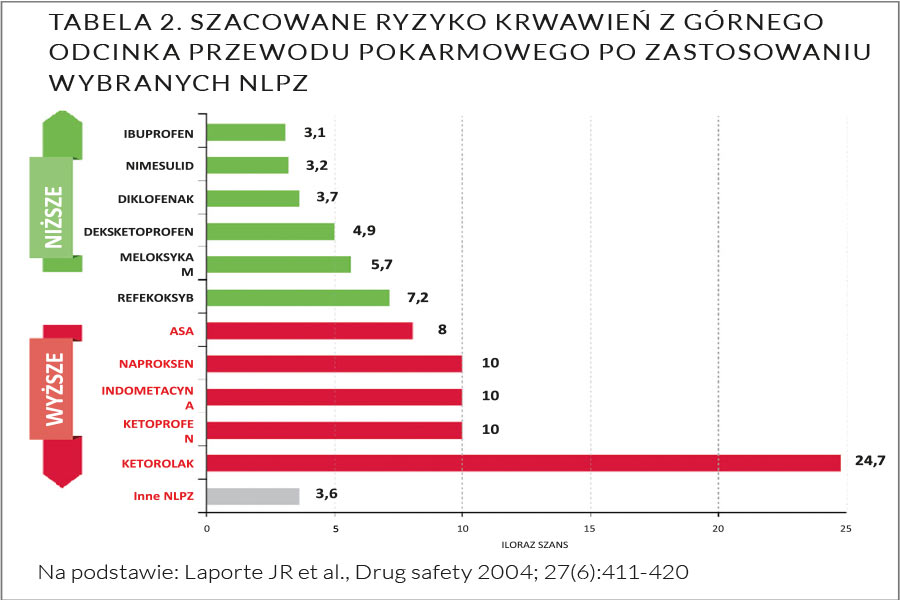
Ważnym parametrem jest też okres półtrwania (T1/2). Izomery (np. deksketoprofen, deksibuprofen) charakteryzują się bardzo krótkim okresem półtrwania, przy działaniu przeciwbólowym do 8 h. Ryzyko uszkodzenia nerek, szczególnie u osób starszych, jest większe przy stosowaniu NLPZ w stanie odwodnienia, zwłaszcza w przypadku leków o długim okresie półtrwania. Im krótszy okres półtrwania (T1/2), tym krótszy czas zahamowania syntezy prostanoidów o działaniu cytoprotekcyjnym w przewodzie pokarmowym, nerkach i układzie krążenia.
| Tabela 3. CZY OKRES PÓŁTRWANIA (T 1/2) MA ZNACZENIE? |
|
| Substancja czynna | T 1/2 |
| deksketoprofen | 1,65 |
| deksibuprofen | 1,85 – 3,5 |
| diklofenak | 2 |
| ibuprofen | ok. 2 |
| ketoprofen | 2 |
| nimesulid | 3,2 – 6 |
| lornoksykam | 4 – 4,3 |
| aceklofenak | 12 – 15 |
| meloksykam | ok. 20 |
| nabumeton | 24 |
| piroksykam | 37,5 (± 2,84) |
Piśmiennictwo dostępne u autora







